はじめに・・・
molとかってのがよく分からん。鉛筆12本を1ダースっていうのと同じ感覚らしいけど・・・。
結局molって何なん?


化学においては重要な単位でね。化学(計算)はmolが基本っていっても過言ではない。
?


まあ、やってみるか♪
原子は小さすぎるからひとまとめにしないと重さが量れない・・・mol
物体は原子とかいうすごく小さい粒から出来ている・・・
講師(以下 講):全ての物体は原子とかいう小さい粒から出来ているってのは中学校で学んだと思うが・・・。
生徒(以下 生):それは知ってる。
講:じゃあさ、原子の重さってどれくらいなんやろうか?
生:すごく小さいってことは、すごく軽いんじゃね?
講:そう。すごく小さい。だから現実的に扱いにくい。なんかいい方法はないんだろうか・・・って考えた人がいた。
生:なんかそれも習った気がする。忘れたけど。
講:まあいいでしょう。そこは。ま、テストで聞かれることもあるけど。今は置いておこう。で、その人が導き出したのが
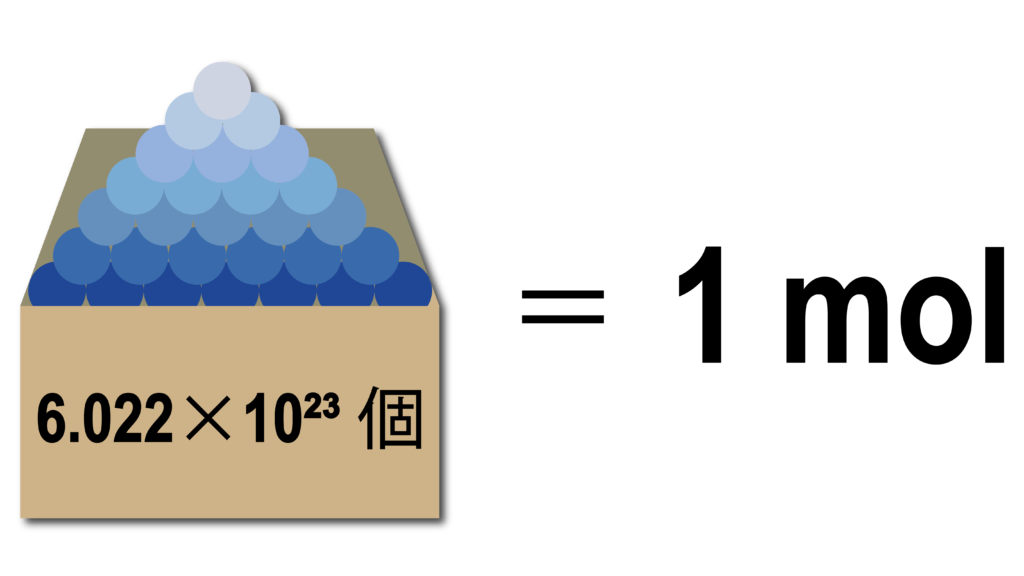
炭素原子を6×10²³個集めたら12gだった
ってこと。
生:どうやって見つけたんやろ・・・。
講:ど~なんやろね。それにしてもよく見つけたというかなんというか・・・。で、この「6×10²³個の集まりを1molって単位にしよう!」ってことにしたそうです。
生:う~ん。
講:じゃあ他に同じような例を・・・。「鉛筆12本で1ダース」。これが教科書とかによく載ってるけど、他に何か知らん?
生:ひとまとめにしたら単位が変わる・・・。あ、米って1合とか1升とか言うんじゃなかったっけ?
講:そうやね。「米は約180gで1合」。確かに米は「何粒食べる」とか言わないですよね。細かすぎて。そんな感じでいいんです。そうやって「ある程度の量をひとまとめにしたもので考えていく」。それが分かっておくといいと思う。
化学反応式もmolで書かれている
講:molってのが少し見えてきたようなので、今度は化学反応式で見てみようか。中学校で習った
「水素と酸素が反応して水ができる」を化学反応式で書いてみましょうか。
生:水素はH₂で酸素はO₂だったよね。
講:うん。
生:じゃあこんな感じ♪
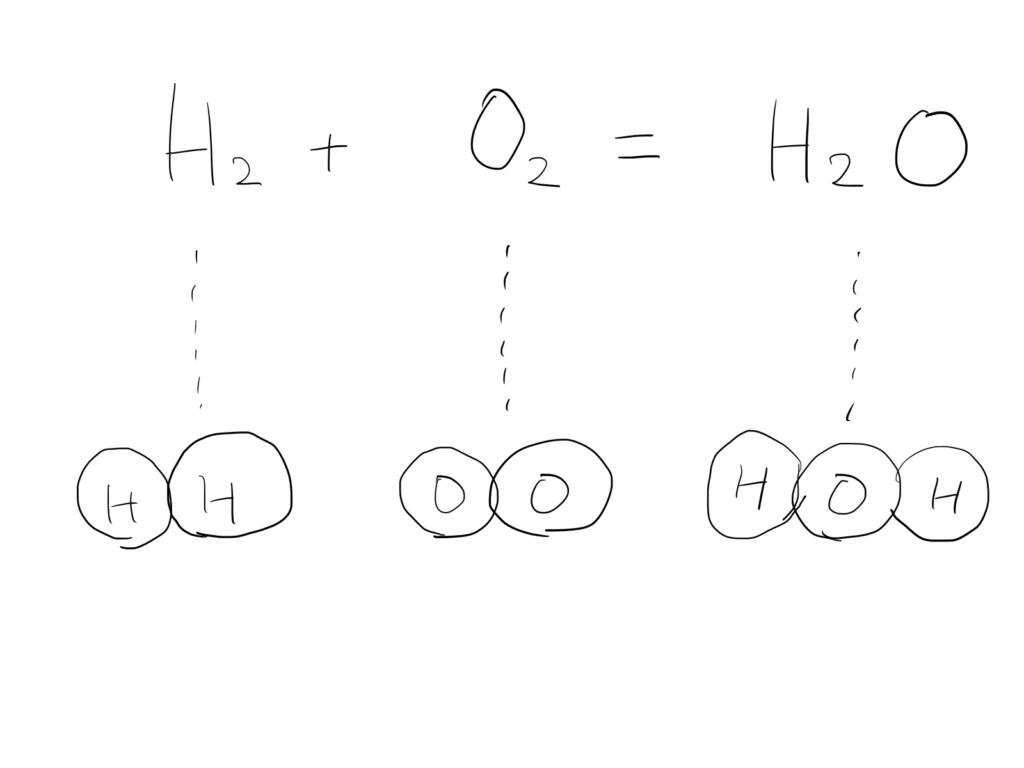
講:まあいい感じですな。ここでちょいと付け加えてみると・・・左辺と右辺の原子の数はこうなるよね。なんか左辺と右辺で酸素原子の数が違ってるよね。
生:うわぁ・・・こんなのあったよな・・・キライや。
講:ま、これくらいならね。どれかを適当に整数倍しとけばいいんでH₂Oを2倍しときましょうか。
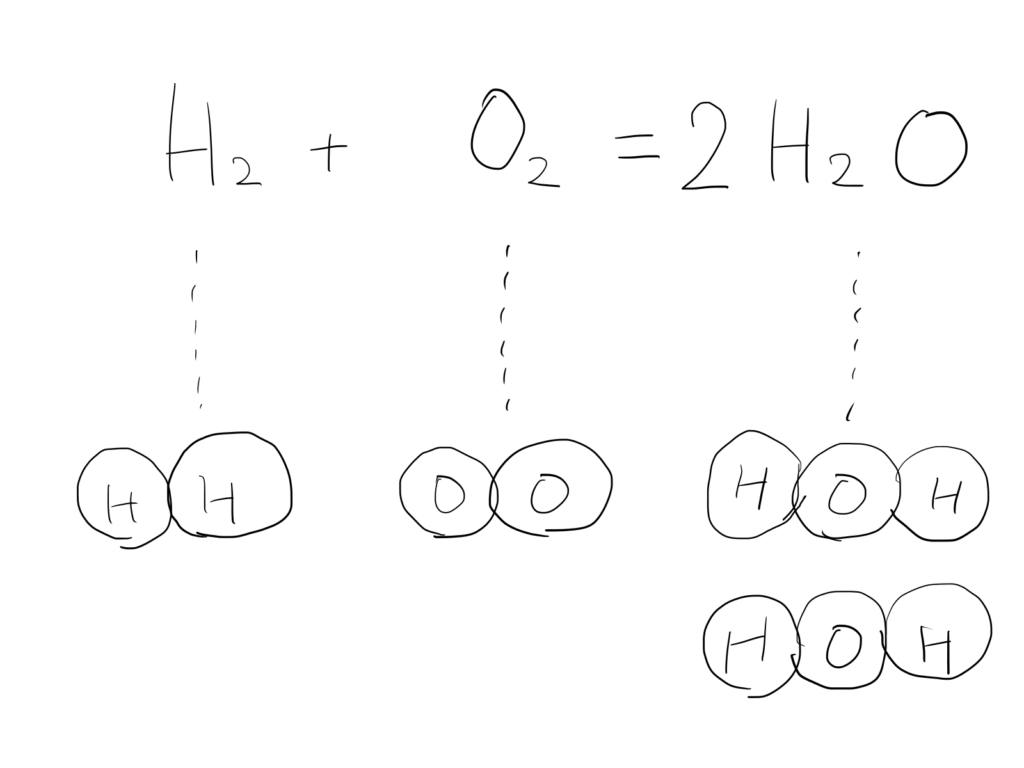
生:まだ揃ってない・・・。
講:じゃあどうしようか?
生:今度はH₂を2倍か・・・。
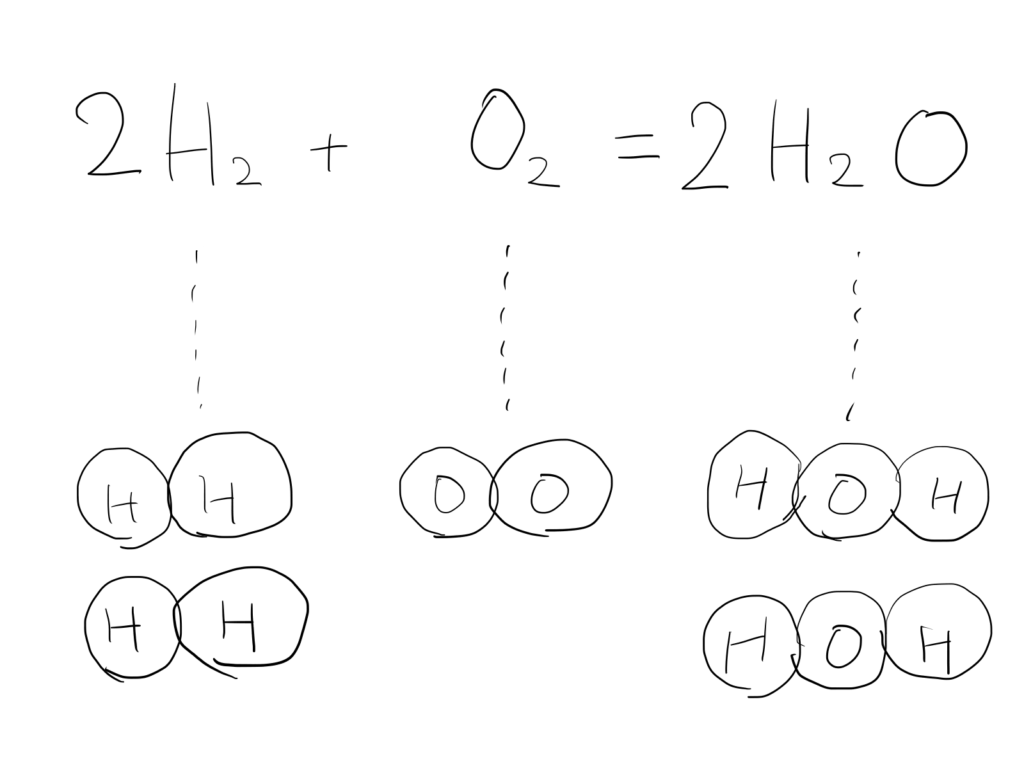
講:いいですな♪これで揃った!
あとは等号イコールじゃなくて矢印にしとうこうか。
生:できた。
講:で、ここからが本題なんだけど、この記号の前に付いている数字がmolを表現してます。つまり

「水素2molと酸素1molで水が2molできる」
こういったことをこの化学反応式は表現しています。
D:ほう。
計算はmolっていう単位で行う(1)
化学反応式がmolを基準にして書かれているということが分かってきたようです・・・さらに話は進みます。
講:じゃあ次は計算もmolが基準になっているということを見ていこうか♪
生:計算・・・ですか。
講:まあねぇ・・・。計算問題もたくさんあるからなぁ・・・。じゃあこんな問題で見ていこうか。
「水素2gを十分な量の酸素で反応させて水をつくりました。
このとき使った酸素と生成した水はそれぞれ何gか?」
生:ムリやな。
講:まあ、そう言わずに。出来るようになるから♪
講:まず、化学反応式を書いてみよう。次にそれぞれの係数がmol数なので、それも書いておこう。
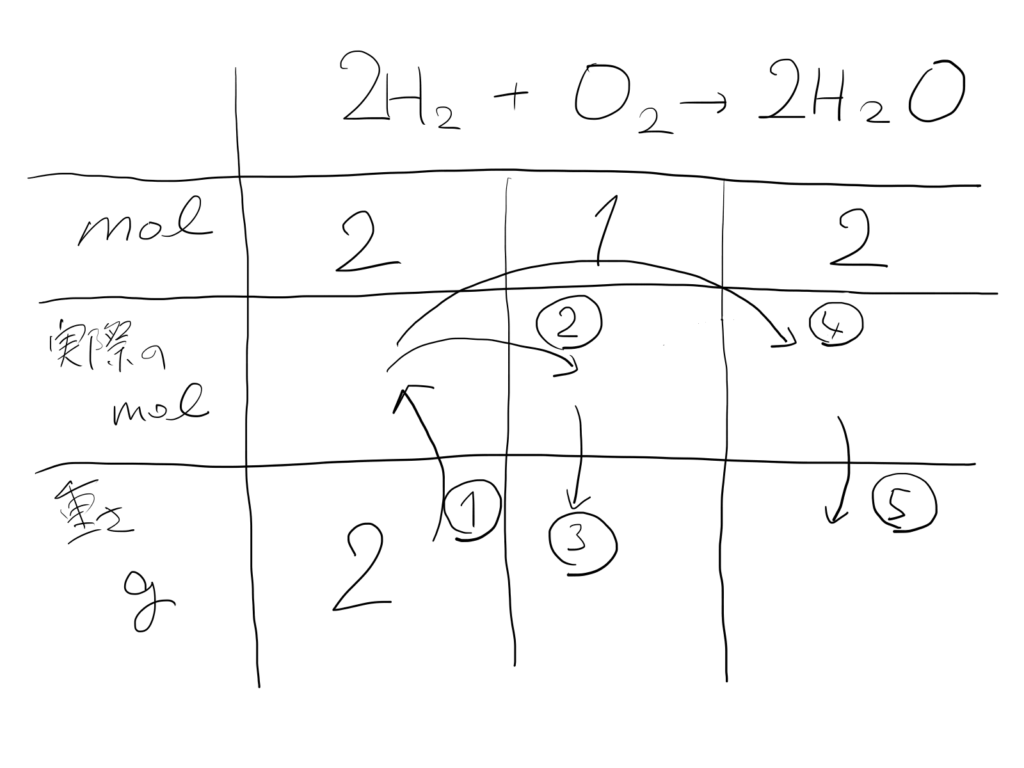
生:こんな感じ?
講:そうですね。で、次に実際のmol数と重さgを書く欄も作っておきましょう。
講:で、この図を①~④のとおりに埋めていくと・・・答えが出てきます。で、全て比例式で計算していきましょうか。
計算はmolっていう単位で行う(2)
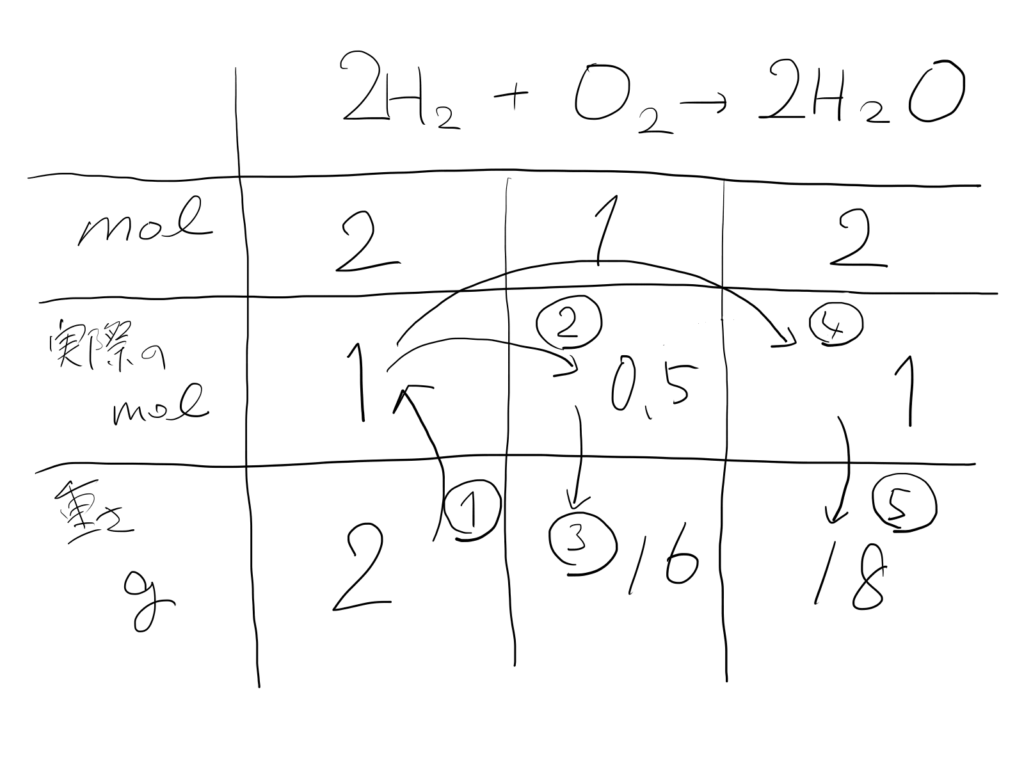
①「重さg→mol」
H₂は1molが1gなので、実際のmol数をXとして
1mol:2g=Xmol:2g
X=1
②「H₂のmol→O₂のmol」
化学反応式より2molのH₂と1molのO₂が反応する
ここでは1molのH₂と反応するO₂を求めたいので
2mol:1mol=1mol:Xmol
X=0.5
③「O₂mol→O₂の重さg」
O₂は1molが32gなので、実際のmol数をXとして
1mol:32g=0.5mol:Xg
X=16
④「H₂のmol→H₂Oのmol」
化学反応式より2molのH₂と2molのO₂が反応する
ここでは1molのH₂と反応するO₂を求めたいので
2mol:2mol=1mol:Xmol
X=1
⑤「H₂Oのmol→H₂Oの重さg」
H₂Oは1molが18gなので、実際のmol数をXとして
1mol:18g=1mol:Xg
X=18
講:こんな感じで表を埋めていけば、自然と答えが出てきます。そのときに比例式を使いまくる・・・こんなやり方。
生:こうやってちょっとずつなら理解できるな。
講:そうやな。一気にやろうとしないことかな。
家庭教師のご依頼も受け付けています
・最終目標の設定
↓
・中期目標の設定
↓
・短期目標の設定
↓
・目標(点数)達成のための効率の良い学習プランの作成と実行
を行って
・「志望校への合格」
・「成績アップ」
を達成しています。


